- 1094
- 产品价格:999.00 元/个 起
- 发货地址:上海浦东金桥 包装说明:不限
- 产品数量:9999.00 个产品规格:不限
- 信息编号:149221067公司编号:14618482
- 袁阳 经理 微信 134726246..
- 进入店铺 在线咨询 QQ咨询 在线询价
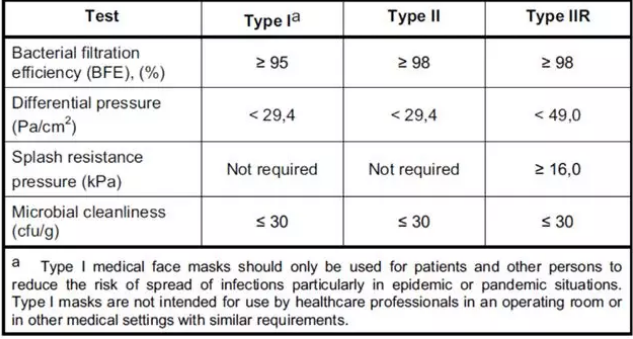
泰州口罩CE认证费用和周期
- 相关产品:
I级医疗器械CE认证标记:
与其他类型的医疗设备相比,I类医疗设备被视为低风险设备。根据欧洲MDD,非无菌且不可测量的I类设备免于公告机构审核和认证。
牙科椅设备CE认证
1类医疗器械-示例
手臂、吊带、牙科椅、考试服、钳子、面具、病床可、重复使用的手术器械
夹板、灭菌包装、袜、de降压器
牙刷、尿袋、轮椅
1类设备可以分为三种,[a] 1类设备,[b] 1类无菌设备,[c] 1类测量设备:
[a] 1类设备
所有1类医疗设备都可以通过准备符合性声明并符合其他要求的自我声明来粘贴CE认证标志。但是大多数制造商仍然依赖第三方认证来获得的CE认证证书。
[b] I类无菌设备
等级1的无菌医疗器械CE认证标记,必须经过通知的身体参与。1级无菌制造商应执行ISO 13485并推荐认证,GMP控制是必要的。
[c] 1类测量设备
只有通过遵守MDD要求和协调标准,然后将技术文件提交*机构和现场审核,才能完成1类测量设备的CE认证标记过程。另外MEDDEV2。应遵循1/5指南。
怎么判断医疗设备-Class Im(测量设备)?
确定具有测量功能的设备的标准。
如果同时满足以下条件,则表明该设备具有测量功能:
1.该设备旨在定量地测量生理或解剖学参数,或者-测量能量或传递给人体或从人体去除的物质的数量或合格特性。
2.测量结果以法令80/181 / EEC的含义以法定单位或其他可接受的单位显示,或者与符合前述指令的法定单位或其他可接受的单位中指示的至少一个参考点进行比较。
3.预期目的隐含了明确或隐含要求的准确性。
本建议书不涵盖制造过程中的测量活动(包括用于校准目的的测量活动),并不表示制造的设备具有测量功能。
具有测量功能的I类设备的示例:
1.用于测量体温的非活动设备。
2.包括非活动温度显示的奶嘴。
3.用于指示体温**或低于*值的设备。
4.用于测量血压的非主动非侵入式设备。
5.用于测量眼压的非主动装置。
6.用于测量输送到人体或从人体排出的液体或气体的体积或流量的设备。
7.用于将液体输送到人体的设备(例如药勺,杯子,滴管,没有刻度或刻度)。
8.用于显示生理参数趋势的设备(例如没有刻度或刻度的尿液引流袋,肥胖卡尺)。
9.视力表
注:-假设相关的分类规则允许在类中分类,但前提是要满足相关的标准。
具有测量功能的1类设备在无菌条件下包装和提供,需要提供《合格机构证明》,而非无菌1类测量设备则不需要!
ISO 13485是自愿的
Ir类可重复使用的手术器械CE认证:
欧盟MDR 2017/745引入了可重复使用手术器械的新要求。所有可重复使用的手术器械均属于1r级,并需要经过认证机构的合格评定。
可重复使用的手术器械被定义为“在切割,钻孔,锯切,刮擦,刮擦,夹持,缩回,修剪或类似程序中用于外科手术的器械,未连接有源设备,制造商打算在使用后重新使用”已经执行了适当的程序,例如清洁,消毒和灭菌
外科手术器械CE认证
可以通过以下方法实现*20.1、20.3、20.4和20.5条以及*52条(7c)规定的MDR类Ir CE认证标记:
1.检验和测试每种产品或同类产品(附件IV)
2.根据附件VIII*1章*2.3节(附件V)和EN ISO 13485:2016审核生产质量保证体系(不包括设计)
3.终检验和测试审核(附件VI)EN ISO 13485:2016(不包括设计与制造)
4.全面质量保证体系审核(附件II)EN ISO 13485:2016
CE分类可能会因预期用途而异,请与MDD 93/42/EEC附件IX核对您的设备分类。
我们可以协助您:
1.医疗器械分类
2.确定MDR要求
3.确定统一标准
4.ISO 13485实施
5.识别公告机构
6.技术文件准备
7.技术文件提交给公告机构
8.重新提交技术文件
9.协助公告机构审核
10.协助解决不合格项
11.贴上CE认证标志
一.医疗器械CE认证(MDD指令)概述
欧盟为消除各成员国间的贸易壁垒,逐步建立成为一个统一的大市场,以确保人员、服务、资金和产品(如医疗器械)的自由流通。在医疗器械领域,欧盟会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。
这三个指令分别是:
1. 有源植入性医疗器械指令(AIMD, 90/335/EEC),适用于心脏起搏器,可植入的泵等有源植入性医疗器械。AIMD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日强制实施。
2. 活体外诊断器械指令(IVD),适用于血细胞计数器,妊娠检测装置等活体外诊断用医疗器械。该指令目前仍在起草阶段,可能于1998年末或1999年初正式实施。
3. 医疗器械指令(Medical Devices Direc-tive,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械,如无源性医疗器械(敷料、一次性使用产品、接触镜、血袋、导管等);以及有源性医疗器械,如核磁共振仪、超声诊断和治疗仪、输液泵等。
二.医疗器械CE认证(MDD指令)核心要求:
(一)基本要求(总要求)
a)安全性(任何风险与器械提供的益处相比较,必须在可以接受的范围内,故亦称风险分析);
b)风险的可预防性或被消除性,至少应给予警告(报警系统或警戒报警系统);
c)性能符合性(产品的基本要求);
d)器械性能和安全的效期(器械的安全和性能必须在器械的使用寿命内得到保证。);
e)器械的储存和运输(应保证器械在合理的运输、储存条件下不受影响)。
(二)基本要求的具体包括如下14条:
1. 器械设计和生产必须保证:按照其预定和条件使用,器械不会损害医疗环境、患者安全、操作者或其他人员的安全和健康;使用时的潜在危险与患者受益相比较可以为人们所接受,但应具有高水平的防护办法。
2. 生产者的设计和制造方案,必须考虑在现有工艺技术条件下遵守安全准则、生产者应:
首先:应尽可能降低甚至避免危险
其次:对无法避免的危险采取适当的防护措施,包括安装报警装置;
*后,告知用户所提供防护措施的弱点及其可能带来的危险。
3. 器械必须取得生产者期望获得的功能。器械设计制造和包装应有利于条(2)(A)D多规定的各项功能的发挥。
4. 在生产线者确定的器械使用寿命期内,在正常使用可能出现的压力,第1、2、3款所指的各项性能应保持稳定,不能危害医疗环境、危害患者、使用者或其他人员的健康。
5. 器械的设计、生产和包装应当保证,器械的性能在运输和储存过程中只要遵守有关规定不会发生根本逆变。
6. 的大小同器械的使用性能相比较可以为人们所接受。
7. 化学、物理和生物性能
8. 感染和微生物污染。
9. 组装和环境因素
10. 检测器械
11. 辐射防护
12. 带有能源或与其他能源相连接的器械
13. 生产者提供的操作信息
14. 如果需要根据医疗数据确定器械是否满足基本要求,如*六款的情形,有关数据必须按照附录Ⅹ的规定取得。
三.医疗器械CE认证(MDD指令)产品分类
医疗器械指令附录九中详定18条规则,按医疗产品的危险程度,将产品分为Ⅰ类、Ⅱa类、Ⅱb类、Ⅲ类。
产品分类规则:
1、规则应用由器械的预期使用目的决定;
2、如果器械是和其它器械配合使用,分类规则分别适用于每种器械;
3、附件可以和其它一起使用的器械分开单独分类;
4、启动或影响某种器械的软件与器械属于同一类型。
分类准则:
时 间: 暂时 (<60分钟)、短期(<30天)、长期(>30天)
创伤性:非创伤、通过孔径创伤,外科创伤 、植入。
适用位置:循环、**神经系统,其它地方。
能量供应:无源,有源。
规则1~4、所有非创伤性器械均属于I类,除非他们:
用于储存体液(血袋例外) II a类
于Ila类或更高类型的有源医疗器械类 II a类
改变体液成分 II a/II b类
一些伤口敷料 II a/II b类
规则5、侵入人体孔径的医疗器械
暂时使用(牙科压缩材料、检查手套) I类
短期使用(导管、隐形眼镜) II a类
长期使用(正常牙线) II b类
规则6-8、外科创伤性器械
再使用的外科器械(钳子,斧子) I类
暂时或短期使用(缝合针。外科手套) 11a类
长期使用(假关节,眼内晶体) II b类
与循环系统(CCS)或**神经系统接触的器械 III类
规则13、与医用物质结合的器械(含杀的避孕套、含抗生素的牙髓材料) III类
规则14、避孕用具(避孕套、帽 II b类 ) II b/III类 (内避孕器III类)
规则15、清洗或消毒的器械
医疗器械(内窥镜消毒) II a类
接触镜(消毒液、护理液) II a类
规则16、用于记录X射线图象的器械(X光片) II a类
规则17、利用动物组织的器械(生物)心脏瓣膜、肠线、胶原) III类
规则18、血袋 II b类
规则9、给予或交换能量的**器械 II a类
(肌肉器、电钻、皮肤光疗机、助听器)一一种潜在危险方式工作的 IIb类
(婴儿培养箱、高频电刀、超声碎石机、X光机)
规则10、诊断器械
提供能量(核磁共振,超声诊断仪) II a类
诊断/监视体内放射药物分布 II a类
(r照相机、正电子发射成像仪)
诊断/监视生理功能(心电图、脑电图) II a类
危险情况下监视生理功能 II b类
(手术中的血气分析仪)
发出电离辐射(X射线诊断议) II b类
规则11 控制药物或其他物质进出人体的有源器械 II a类
(吸引设备、供给泵)
如以一种潜在危险方式工作 II b类
(麻醉机、呼吸机、透析机、高压氧舱)
规则12.所有其他有源医疗器械属于I类
(观察灯、牙科椅、轮椅、牙科用**灯、记录处理观察诊断图象用的有源器械)
四.医疗器械CE认证(MDD指令)技术文档(TCF)要求
“技术文档"是欧盟医疗器械指令中很重要的一个事项,它的目的是要求企业准备充份的技术资料和证明,供主管机关抽查,或发生诉讼纠纷时使用。医疗器械指令MDD 93/42/EEC要求"技术档案"可能包含下列项目:
A. 企业的质量手册和程序文件
B. 企业简介及欧洲授权代表名称、联系方式
C.CE符合性声明(或称自我保证声明,若该产品是和其它设备联合运用,则应有整体符合基本要求的证明材料)
1. 产品名称、分类及引用标准条款的简要描述
2. 产品概述(包括类型和预期用途)
a) 产品的历史沿革
b) 技术性能参数
c) 产品配合使用的附件、配合件和其它设备清单
d) 产品的图示与样品
e) 产品所用原材料及供应商
3. 使用该产品的调和标准/或其它标准
4. 风险分析评估结论和预防措施(ISO14971产品服务危险分析报告)
5. 生产质量控制
a) 产品资料和控制文档(包括产品生产工艺流程图)
b) 产品的灭菌方法和确认的描述
c) 灭菌验证
d) 产品质量控制措施
e) 产品稳定性和效期的描述
6.包装和标识
a) 包装材料说明
b) 标签
c) 使用说明书
7. 技术评价
a) 产品检验报告及相关文献
b) 技术概要及*观点
8. 潜在风险评价
a) 产品潜在风险测试报告及相关文献
b) 潜在风险的概要及*观点
9. 临床评价
a) 产品临床测试报告及相关文献
b) 临床使用概述及*观点
附录1、产品出厂检测报告
附录2、产品型式检测报告
附录3、基本要求检查表
注:
1. 临床研究(包括:物理性能,生化、药理 、药动及毒性研究,功效测试,灭菌合格证明,药物相容性等)
2. 生物兼容性测试(A)EN30993 部分要求:细胞毒性、感光性、-皮内反应、急性全身中毒、致热性、亚急性中毒、遗传毒性、植入溶血性;B)支持测试:慢性 中毒、致性、再生性/生长性、生物动因退化。)
3. 临床资料(需要临床研究或描述临床研究)
4. 包装合格证明(EN868)
5. 标签、使用说明(EN980、EN1041)
6. 结论(设计档案资料的接受、利益对应风险的陈述)
医疗设备CE认证介绍:
如果您是制造商,并且想要将医疗设备投放到欧盟市场,则需要确保其符合欧盟会制定的特定欧洲指令。在这种情况下,重要的是医疗器械指令(MDD):AIMDD 90/385 / EEC;MDD 93/42 / EEC;IVDMDD 98/79 / EC。
为了证明您的设备符合这些CE指令的基本要求,您需要在其上粘贴CE标记,为此,您的产品需要经过CE标记过程。后者的方向取决于您的医疗设备的类别以及您对合格评定路线的选择;您的医疗设备的特定特征将决定其类别,以及对患者的风险程度。例如,诸如预期用途,侵入性以及局部与全身作用等特征。
医疗器械CE认证分为几类?
根据欧洲框架,医疗设备分为四类:I,IIa,IIb和III类。III类医疗器械风险。如今,由于新法规系统的严格规定,许多设备的类别发生了变化,在将它们放入IIa或IIb类之前,但现在它们将进入III类。
如果您的医疗设备属于I类以外的任何其他类别,则您必须向认证机构提供证明,证明您的产品符合相应CE指令的基本要求。继续阅读以了解有关每个课程的更多信息,以及需要通过哪些步骤才能通过CE标志医疗器械。
一级医疗器械CE认证
类医疗设备的风险,这种设备的制造商可以从三种可能的CE标记途径中选择一种。在这方面,他们应该考虑以下方面:医疗设备是否无菌,例如个人保护套件;医疗设备是否具有测量功能,例如听诊器;如果不是无菌的,也不能测量例如矫正眼镜。
如果您的产品属于I类,并且不是无菌设备或测量设备,那么您要做的就是自我认证,并通过书面声明正式声明其符合MDD的适用要求。如果它是无菌的或可测量的医疗设备,那么您将需要经过公告的身体评估。
IIa类医疗设备CE认证
IIa类的医疗设备可能是手术手套,助听器,超声诊断仪等,它们通常构成中低风险,患者应在短于30天的短期内使用它们。如果您是IIa类医疗设备的制造商,则必须备份符合声明的人体评估声明。只有这样,您才可以将您的产品投放市场。有四种可能的CE标志产品的途径,根据产品的类型(即是否经过消毒)分为两组。
III类医疗设备CE认证
在该类别中,所有医疗设备都可能具有的风险,因此在其使用寿命期间需要进行*监控。有专门机构负责产品的监控。这样的装置例如是心血管导管,动脉夹,髋关节植入物,人工心脏瓣膜等。在这里,以及在*II类中,医疗器械的合格性评估可能包括对技术文档和质量体系/产品检查的审核,并将重点放在器械设计和生产的一个或多个方面。
医疗器械MDD认证
医疗器械MDD认证
医疗器械CE认证简介
在医疗器械领域,欧盟会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。分别为:
医疗器械指令MDD(Medical Devices):93/42/EEC,适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械。
体外诊断指令IVDD(In vitro diagnostic medical devices):98/79/EC,适用于血细胞计数器,妊娠检测装置等活体外诊断用医疗器械。
有源植入性医疗器械指令AIMDD(Active implantable medical devices):90/385/EEC,适用于心脏起搏器,可植入的泵等有源植入性医疗器械。
医疗器械MDD指令的分类等级
MDD指令根据不同的要求共分为6个等级,供认证机构评估:
等级 设计阶段 生产阶段
I类 自我符合声明 自我符合声明
I类(测量功能) 自我符合声明 申报机构
I类(灭菌) 自我符合声明 申报机构
II a类 自我符合声明 申报机构
II b类 申报机构 申报机构
III类 申报机构 申报机构
医疗器械CE认证所需技术资料
认证机构的统一评估包括根据指令规定的基本要求评审技术文件、根据标准EN 46001 或 EN/ISO 13485评审质量体系。医疗设备CE认证技术档案所需内容:
- 生产商/或欧洲代表名址;
- 产品及型号描述;
- EC符合声明书;
- 风险评估;
- 基本安全点检表;
- 适用之调合标准/或其他标准;
- 市场反馈及抱怨分析;
- 使用说明及标签;
- 授权代表;
- 线路、图表(适用的话);
- 计算书、测试报告或其它证明材料;
- 检验过程及过程描述;
- 灭菌或其它特殊过程(适用的话);
- 灭菌类产品的包装材料及方法;
-质量体系、质量手册;
欢迎来到上海沙格企业管理咨询有限公司网站,我公司位于历史文化悠久,近代城市文化底蕴深厚,历史古迹众多,有“东方巴黎”美称的上海市。 具体地址是上海浦东金桥世纪大道1500号,联系人是袁阳。与其他类型的医疗设备相比,I类医疗设备被视为低风险设备。根据欧洲MDD,非无菌且不可测量的I类设备免于公告机构审核和认证。
牙科椅设备CE认证
1类医疗器械-示例
手臂、吊带、牙科椅、考试服、钳子、面具、病床可、重复使用的手术器械
夹板、灭菌包装、袜、de降压器
牙刷、尿袋、轮椅
1类设备可以分为三种,[a] 1类设备,[b] 1类无菌设备,[c] 1类测量设备:
[a] 1类设备
所有1类医疗设备都可以通过准备符合性声明并符合其他要求的自我声明来粘贴CE认证标志。但是大多数制造商仍然依赖第三方认证来获得的CE认证证书。
[b] I类无菌设备
等级1的无菌医疗器械CE认证标记,必须经过通知的身体参与。1级无菌制造商应执行ISO 13485并推荐认证,GMP控制是必要的。
[c] 1类测量设备
只有通过遵守MDD要求和协调标准,然后将技术文件提交*机构和现场审核,才能完成1类测量设备的CE认证标记过程。另外MEDDEV2。应遵循1/5指南。
怎么判断医疗设备-Class Im(测量设备)?
确定具有测量功能的设备的标准。
如果同时满足以下条件,则表明该设备具有测量功能:
1.该设备旨在定量地测量生理或解剖学参数,或者-测量能量或传递给人体或从人体去除的物质的数量或合格特性。
2.测量结果以法令80/181 / EEC的含义以法定单位或其他可接受的单位显示,或者与符合前述指令的法定单位或其他可接受的单位中指示的至少一个参考点进行比较。
3.预期目的隐含了明确或隐含要求的准确性。
本建议书不涵盖制造过程中的测量活动(包括用于校准目的的测量活动),并不表示制造的设备具有测量功能。
具有测量功能的I类设备的示例:
1.用于测量体温的非活动设备。
2.包括非活动温度显示的奶嘴。
3.用于指示体温**或低于*值的设备。
4.用于测量血压的非主动非侵入式设备。
5.用于测量眼压的非主动装置。
6.用于测量输送到人体或从人体排出的液体或气体的体积或流量的设备。
7.用于将液体输送到人体的设备(例如药勺,杯子,滴管,没有刻度或刻度)。
8.用于显示生理参数趋势的设备(例如没有刻度或刻度的尿液引流袋,肥胖卡尺)。
9.视力表
注:-假设相关的分类规则允许在类中分类,但前提是要满足相关的标准。
具有测量功能的1类设备在无菌条件下包装和提供,需要提供《合格机构证明》,而非无菌1类测量设备则不需要!
ISO 13485是自愿的
Ir类可重复使用的手术器械CE认证:
欧盟MDR 2017/745引入了可重复使用手术器械的新要求。所有可重复使用的手术器械均属于1r级,并需要经过认证机构的合格评定。
可重复使用的手术器械被定义为“在切割,钻孔,锯切,刮擦,刮擦,夹持,缩回,修剪或类似程序中用于外科手术的器械,未连接有源设备,制造商打算在使用后重新使用”已经执行了适当的程序,例如清洁,消毒和灭菌
外科手术器械CE认证
可以通过以下方法实现*20.1、20.3、20.4和20.5条以及*52条(7c)规定的MDR类Ir CE认证标记:
1.检验和测试每种产品或同类产品(附件IV)
2.根据附件VIII*1章*2.3节(附件V)和EN ISO 13485:2016审核生产质量保证体系(不包括设计)
3.终检验和测试审核(附件VI)EN ISO 13485:2016(不包括设计与制造)
4.全面质量保证体系审核(附件II)EN ISO 13485:2016
CE分类可能会因预期用途而异,请与MDD 93/42/EEC附件IX核对您的设备分类。
我们可以协助您:
1.医疗器械分类
2.确定MDR要求
3.确定统一标准
4.ISO 13485实施
5.识别公告机构
6.技术文件准备
7.技术文件提交给公告机构
8.重新提交技术文件
9.协助公告机构审核
10.协助解决不合格项
11.贴上CE认证标志
一.医疗器械CE认证(MDD指令)概述
欧盟为消除各成员国间的贸易壁垒,逐步建立成为一个统一的大市场,以确保人员、服务、资金和产品(如医疗器械)的自由流通。在医疗器械领域,欧盟会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。
这三个指令分别是:
1. 有源植入性医疗器械指令(AIMD, 90/335/EEC),适用于心脏起搏器,可植入的泵等有源植入性医疗器械。AIMD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日强制实施。
2. 活体外诊断器械指令(IVD),适用于血细胞计数器,妊娠检测装置等活体外诊断用医疗器械。该指令目前仍在起草阶段,可能于1998年末或1999年初正式实施。
3. 医疗器械指令(Medical Devices Direc-tive,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械,如无源性医疗器械(敷料、一次性使用产品、接触镜、血袋、导管等);以及有源性医疗器械,如核磁共振仪、超声诊断和治疗仪、输液泵等。
二.医疗器械CE认证(MDD指令)核心要求:
(一)基本要求(总要求)
a)安全性(任何风险与器械提供的益处相比较,必须在可以接受的范围内,故亦称风险分析);
b)风险的可预防性或被消除性,至少应给予警告(报警系统或警戒报警系统);
c)性能符合性(产品的基本要求);
d)器械性能和安全的效期(器械的安全和性能必须在器械的使用寿命内得到保证。);
e)器械的储存和运输(应保证器械在合理的运输、储存条件下不受影响)。
(二)基本要求的具体包括如下14条:
1. 器械设计和生产必须保证:按照其预定和条件使用,器械不会损害医疗环境、患者安全、操作者或其他人员的安全和健康;使用时的潜在危险与患者受益相比较可以为人们所接受,但应具有高水平的防护办法。
2. 生产者的设计和制造方案,必须考虑在现有工艺技术条件下遵守安全准则、生产者应:
首先:应尽可能降低甚至避免危险
其次:对无法避免的危险采取适当的防护措施,包括安装报警装置;
*后,告知用户所提供防护措施的弱点及其可能带来的危险。
3. 器械必须取得生产者期望获得的功能。器械设计制造和包装应有利于条(2)(A)D多规定的各项功能的发挥。
4. 在生产线者确定的器械使用寿命期内,在正常使用可能出现的压力,第1、2、3款所指的各项性能应保持稳定,不能危害医疗环境、危害患者、使用者或其他人员的健康。
5. 器械的设计、生产和包装应当保证,器械的性能在运输和储存过程中只要遵守有关规定不会发生根本逆变。
6. 的大小同器械的使用性能相比较可以为人们所接受。
7. 化学、物理和生物性能
8. 感染和微生物污染。
9. 组装和环境因素
10. 检测器械
11. 辐射防护
12. 带有能源或与其他能源相连接的器械
13. 生产者提供的操作信息
14. 如果需要根据医疗数据确定器械是否满足基本要求,如*六款的情形,有关数据必须按照附录Ⅹ的规定取得。
三.医疗器械CE认证(MDD指令)产品分类
医疗器械指令附录九中详定18条规则,按医疗产品的危险程度,将产品分为Ⅰ类、Ⅱa类、Ⅱb类、Ⅲ类。
产品分类规则:
1、规则应用由器械的预期使用目的决定;
2、如果器械是和其它器械配合使用,分类规则分别适用于每种器械;
3、附件可以和其它一起使用的器械分开单独分类;
4、启动或影响某种器械的软件与器械属于同一类型。
分类准则:
时 间: 暂时 (<60分钟)、短期(<30天)、长期(>30天)
创伤性:非创伤、通过孔径创伤,外科创伤 、植入。
适用位置:循环、**神经系统,其它地方。
能量供应:无源,有源。
规则1~4、所有非创伤性器械均属于I类,除非他们:
用于储存体液(血袋例外) II a类
于Ila类或更高类型的有源医疗器械类 II a类
改变体液成分 II a/II b类
一些伤口敷料 II a/II b类
规则5、侵入人体孔径的医疗器械
暂时使用(牙科压缩材料、检查手套) I类
短期使用(导管、隐形眼镜) II a类
长期使用(正常牙线) II b类
规则6-8、外科创伤性器械
再使用的外科器械(钳子,斧子) I类
暂时或短期使用(缝合针。外科手套) 11a类
长期使用(假关节,眼内晶体) II b类
与循环系统(CCS)或**神经系统接触的器械 III类
规则13、与医用物质结合的器械(含杀的避孕套、含抗生素的牙髓材料) III类
规则14、避孕用具(避孕套、帽 II b类 ) II b/III类 (内避孕器III类)
规则15、清洗或消毒的器械
医疗器械(内窥镜消毒) II a类
接触镜(消毒液、护理液) II a类
规则16、用于记录X射线图象的器械(X光片) II a类
规则17、利用动物组织的器械(生物)心脏瓣膜、肠线、胶原) III类
规则18、血袋 II b类
规则9、给予或交换能量的**器械 II a类
(肌肉器、电钻、皮肤光疗机、助听器)一一种潜在危险方式工作的 IIb类
(婴儿培养箱、高频电刀、超声碎石机、X光机)
规则10、诊断器械
提供能量(核磁共振,超声诊断仪) II a类
诊断/监视体内放射药物分布 II a类
(r照相机、正电子发射成像仪)
诊断/监视生理功能(心电图、脑电图) II a类
危险情况下监视生理功能 II b类
(手术中的血气分析仪)
发出电离辐射(X射线诊断议) II b类
规则11 控制药物或其他物质进出人体的有源器械 II a类
(吸引设备、供给泵)
如以一种潜在危险方式工作 II b类
(麻醉机、呼吸机、透析机、高压氧舱)
规则12.所有其他有源医疗器械属于I类
(观察灯、牙科椅、轮椅、牙科用**灯、记录处理观察诊断图象用的有源器械)
四.医疗器械CE认证(MDD指令)技术文档(TCF)要求
“技术文档"是欧盟医疗器械指令中很重要的一个事项,它的目的是要求企业准备充份的技术资料和证明,供主管机关抽查,或发生诉讼纠纷时使用。医疗器械指令MDD 93/42/EEC要求"技术档案"可能包含下列项目:
A. 企业的质量手册和程序文件
B. 企业简介及欧洲授权代表名称、联系方式
C.CE符合性声明(或称自我保证声明,若该产品是和其它设备联合运用,则应有整体符合基本要求的证明材料)
1. 产品名称、分类及引用标准条款的简要描述
2. 产品概述(包括类型和预期用途)
a) 产品的历史沿革
b) 技术性能参数
c) 产品配合使用的附件、配合件和其它设备清单
d) 产品的图示与样品
e) 产品所用原材料及供应商
3. 使用该产品的调和标准/或其它标准
4. 风险分析评估结论和预防措施(ISO14971产品服务危险分析报告)
5. 生产质量控制
a) 产品资料和控制文档(包括产品生产工艺流程图)
b) 产品的灭菌方法和确认的描述
c) 灭菌验证
d) 产品质量控制措施
e) 产品稳定性和效期的描述
6.包装和标识
a) 包装材料说明
b) 标签
c) 使用说明书
7. 技术评价
a) 产品检验报告及相关文献
b) 技术概要及*观点
8. 潜在风险评价
a) 产品潜在风险测试报告及相关文献
b) 潜在风险的概要及*观点
9. 临床评价
a) 产品临床测试报告及相关文献
b) 临床使用概述及*观点
附录1、产品出厂检测报告
附录2、产品型式检测报告
附录3、基本要求检查表
注:
1. 临床研究(包括:物理性能,生化、药理 、药动及毒性研究,功效测试,灭菌合格证明,药物相容性等)
2. 生物兼容性测试(A)EN30993 部分要求:细胞毒性、感光性、-皮内反应、急性全身中毒、致热性、亚急性中毒、遗传毒性、植入溶血性;B)支持测试:慢性 中毒、致性、再生性/生长性、生物动因退化。)
3. 临床资料(需要临床研究或描述临床研究)
4. 包装合格证明(EN868)
5. 标签、使用说明(EN980、EN1041)
6. 结论(设计档案资料的接受、利益对应风险的陈述)
医疗设备CE认证介绍:
如果您是制造商,并且想要将医疗设备投放到欧盟市场,则需要确保其符合欧盟会制定的特定欧洲指令。在这种情况下,重要的是医疗器械指令(MDD):AIMDD 90/385 / EEC;MDD 93/42 / EEC;IVDMDD 98/79 / EC。
为了证明您的设备符合这些CE指令的基本要求,您需要在其上粘贴CE标记,为此,您的产品需要经过CE标记过程。后者的方向取决于您的医疗设备的类别以及您对合格评定路线的选择;您的医疗设备的特定特征将决定其类别,以及对患者的风险程度。例如,诸如预期用途,侵入性以及局部与全身作用等特征。
医疗器械CE认证分为几类?
根据欧洲框架,医疗设备分为四类:I,IIa,IIb和III类。III类医疗器械风险。如今,由于新法规系统的严格规定,许多设备的类别发生了变化,在将它们放入IIa或IIb类之前,但现在它们将进入III类。
如果您的医疗设备属于I类以外的任何其他类别,则您必须向认证机构提供证明,证明您的产品符合相应CE指令的基本要求。继续阅读以了解有关每个课程的更多信息,以及需要通过哪些步骤才能通过CE标志医疗器械。
一级医疗器械CE认证
类医疗设备的风险,这种设备的制造商可以从三种可能的CE标记途径中选择一种。在这方面,他们应该考虑以下方面:医疗设备是否无菌,例如个人保护套件;医疗设备是否具有测量功能,例如听诊器;如果不是无菌的,也不能测量例如矫正眼镜。
如果您的产品属于I类,并且不是无菌设备或测量设备,那么您要做的就是自我认证,并通过书面声明正式声明其符合MDD的适用要求。如果它是无菌的或可测量的医疗设备,那么您将需要经过公告的身体评估。
IIa类医疗设备CE认证
IIa类的医疗设备可能是手术手套,助听器,超声诊断仪等,它们通常构成中低风险,患者应在短于30天的短期内使用它们。如果您是IIa类医疗设备的制造商,则必须备份符合声明的人体评估声明。只有这样,您才可以将您的产品投放市场。有四种可能的CE标志产品的途径,根据产品的类型(即是否经过消毒)分为两组。
III类医疗设备CE认证
在该类别中,所有医疗设备都可能具有的风险,因此在其使用寿命期间需要进行*监控。有专门机构负责产品的监控。这样的装置例如是心血管导管,动脉夹,髋关节植入物,人工心脏瓣膜等。在这里,以及在*II类中,医疗器械的合格性评估可能包括对技术文档和质量体系/产品检查的审核,并将重点放在器械设计和生产的一个或多个方面。
医疗器械MDD认证
医疗器械MDD认证
医疗器械CE认证简介
在医疗器械领域,欧盟会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。分别为:
医疗器械指令MDD(Medical Devices):93/42/EEC,适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的医疗器械。
体外诊断指令IVDD(In vitro diagnostic medical devices):98/79/EC,适用于血细胞计数器,妊娠检测装置等活体外诊断用医疗器械。
有源植入性医疗器械指令AIMDD(Active implantable medical devices):90/385/EEC,适用于心脏起搏器,可植入的泵等有源植入性医疗器械。
医疗器械MDD指令的分类等级
MDD指令根据不同的要求共分为6个等级,供认证机构评估:
等级 设计阶段 生产阶段
I类 自我符合声明 自我符合声明
I类(测量功能) 自我符合声明 申报机构
I类(灭菌) 自我符合声明 申报机构
II a类 自我符合声明 申报机构
II b类 申报机构 申报机构
III类 申报机构 申报机构
医疗器械CE认证所需技术资料
认证机构的统一评估包括根据指令规定的基本要求评审技术文件、根据标准EN 46001 或 EN/ISO 13485评审质量体系。医疗设备CE认证技术档案所需内容:
- 生产商/或欧洲代表名址;
- 产品及型号描述;
- EC符合声明书;
- 风险评估;
- 基本安全点检表;
- 适用之调合标准/或其他标准;
- 市场反馈及抱怨分析;
- 使用说明及标签;
- 授权代表;
- 线路、图表(适用的话);
- 计算书、测试报告或其它证明材料;
- 检验过程及过程描述;
- 灭菌或其它特殊过程(适用的话);
- 灭菌类产品的包装材料及方法;
-质量体系、质量手册;
联系电话是021-80188750, 主要经营SUNGO集团专注于MDRCE认证、FDA注册和FDA510K、欧盟自由销售证明、FDA验厂、CE临床评估报告、欧盟授权代表和欧盟注册等,经验丰富,值得信赖,欢迎广大客户来电咨询。。
单位注册资金单位注册资金人民币 500 - 1000 万元。